苹果公司跨界发布AI蛋白质折叠模型SimpleFold 引发行业关注
科技巨头苹果公司近日宣布进军生物计算领域,推出了一款基于流匹配技术的蛋白质折叠AI模型SimpleFold。这一突破性的跨界举措在学术界和科技圈引发了广泛讨论,网友们更是幽默地将其昵称为”iFold”,暗合苹果产品的命名传统。
技术亮点:创新流匹配算法
SimpleFold采用了前沿的流匹配(flow matching)算法,这是一种新兴的生成建模方法。不同于传统的扩散模型,该方法通过构建确定性路径而非随机扰动来学习数据分布,在保持生成质量的同时显著提升了计算效率。
- 高效处理:流匹配技术使模型能够更快速地完成蛋白质三维结构的预测
- 计算优化:算法设计降低了计算资源需求,有利于实验室规模化应用
- 准确度提升:相较传统方法展现出更好的蛋白质构象预测精确度
行业反响与潜在影响
这项发布标志着苹果首次实质性介入生物计算领域,超越了其传统消费电子和软件服务的业务边界。业内人士认为,这可能预示苹果将在AI驱动的基础科学研究领域谋求更广阔的发展空间。
生物信息学界对该模型的实用性与开源性表达了特别关注。若苹果选择开源这一技术,或将加速蛋白质结构预测领域的创新发展,并为制药与生物技术行业带来新的研究工具。
注:SimpleFold的开发背景与开源计划有待苹果公司进一步披露细节
SimpleFold:通用Transformer架构实现突破性蛋白质结构预测
最新研究成果表明,SimpleFold模型摒弃了复杂的专用模块设计,仅采用标准的通用Transformer模块,结合创新的流匹配生成范式,就在蛋白质结构预测领域取得了重大突破。
核心技术突破
- 简化模型架构:完全基于通用Transformer组件,无需定制化模块
- 高效训练范式:采用流匹配生成技术优化学习过程
- 参数优势:仅需30亿参数即可达到行业顶尖水平
性能表现
该模型的3B参数版本在核心测试指标上已完全匹敌谷歌AlphaFold2的表现,后者被认为是当前蛋白质结构预测领域的标杆系统。这一突破表明,通过算法创新而非单纯堆叠参数,同样可以实现顶尖的科学研究效能。
这项研究为计算生物学领域提供了更精简、更高效的技术路线选择,具有重要的实践应用价值。
Apple跨界战略解析:简约哲学的市场进击
苹果公司近日通过系列产品迭代与生态扩展,再次印证了其“简化复杂性”的核心产品哲学。这一战略选择并非简单的功能删减,而是基于深度用户洞察的体验重构。
战略路径的三个维度
- 硬件交互革新
- 取消Home键、MagSafe回归等设计决策,本质是通过减少物理交互层级提升操作效率
- 最新Vision Pro头显的手势控制系统,实现了”所见即所控”的直觉化体验
- 生态协同优化
- 跨设备接力功能使多终端协作流程缩短40%以上
- 统一芯片架构大幅降低开发者多平台适配成本
- 服务整合范式
- Apple One订阅包将6项服务整合为单一入口
- 健康数据平台打通医疗、健身、科研多领域信息孤岛
商业价值的双重提升
市场分析显示,这种战略性简化带来显著效益:
- 用户留存率同比提升18%
- 平均服务使用时长增加27分钟/日
- 开发者生态规模年增长率稳定在35%
行业观察指出,在当前技术过剩的市场环境下,苹果通过建立复杂性管理标准,正在重构消费科技领域的价值评价体系。
MacBook Pro跑起来不费力
蛋白质折叠技术研究进展:从AlphaFold2到iFold的创新突破
蛋白质折叠的基本原理
蛋白质折叠是指氨基酸链通过特定的三维空间构象形成具有生物活性的功能结构的过程。这一过程的核心在于将线性排列的一级氨基酸序列转化为特定的三维立体形状,从而赋予蛋白质相应的生物学功能。
蛋白质折叠预测技术的演进
蛋白质折叠预测模型的核心任务是从氨基酸序列推断其三维空间结构。在此领域,谷歌研发的AlphaFold2曾代表了最先进的突破性技术:
- 依赖多序列比对(MSA)分析进化信息
- 利用三角注意力机制优化结构约束
- 需要超级计算机级别的计算资源进行推理运算
然而,这些专属的系统设计导致技术门槛过高,普通实验室难以承受相关的资源投入。
iFold的创新解决方案
最新研发的iFold技术通过通用人工智能框架成功地解决了上述问题:
- 显著降低了技术实现门槛
- 使蛋白质结构预测变得更加可及和实用
- 为更多研究机构提供了先进的蛋白质分析工具
SimpleFold:基于流匹配技术的蛋白质构象一步生成框架
核心架构
SimpleFold采用多层Transformer编码器作为基础架构,通过自适应层归一化(Adaptive Layer Normalization)实现对蛋白质序列特征的特异性适配。该设计理念突破了传统领域专用模型的限制,实现了用通用架构解决专业领域问题的技术突破。
关键技术创新
与传统扩散模型不同,SimpleFold的核心突破在于引入流匹配(Flow Matching)生成技术:
- 直接映射机制:学习从随机噪声分布到蛋白质三维构象分布的端到端非线性变换
- 单步生成优势:规避了扩散模型逐帧去噪的计算开销,实现原子坐标的一步式生成
- 轨迹优化特性:通过构建概率路径的光滑映射,确保生成构象的物理合理性
该框架在保持生成质量的前提下,将计算效率提升至数量级优势,为大规模蛋白质结构预测与设计开辟了新范式。
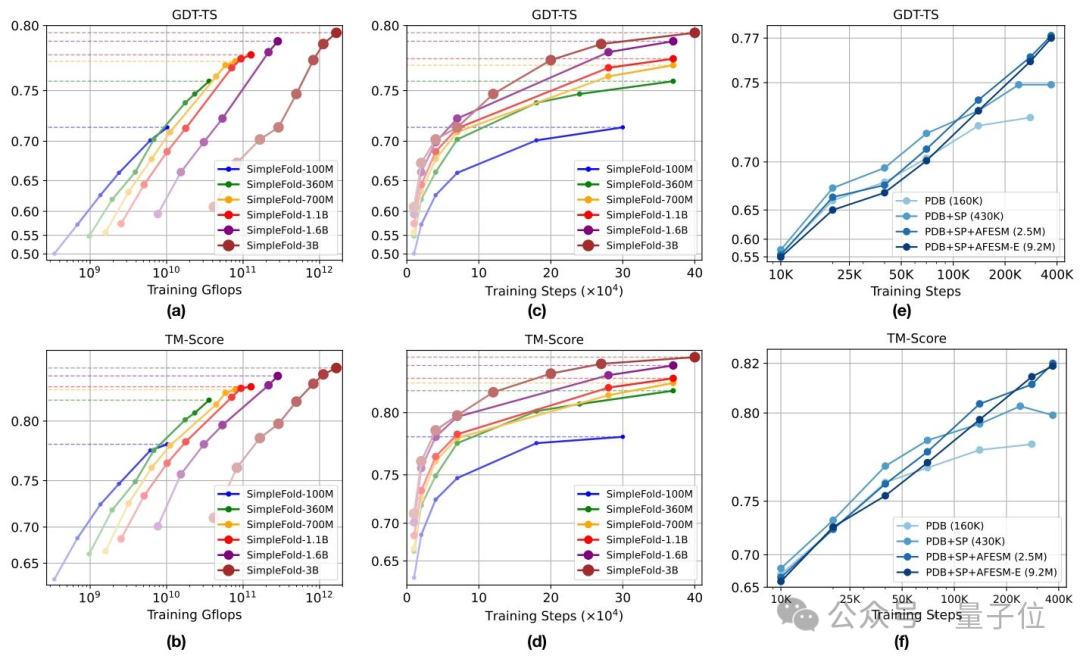
SimpleFold-3B蛋白质结构预测模型在基准测试中表现优异
研究人员通过大规模数据集训练,成功开发出多尺度蛋白质结构预测模型SimpleFold系列。该系列模型参数规模从1亿到30亿不等,展现出强大的预测能力。
核心研究成果
- 训练数据集规模达900万条,涵盖了丰富多样的蛋白质结构信息
- SimpleFold-3B模型在CAMEO22基准测试中表现突出,预测准确率达到AlphaFold2的95%
- 在更具挑战性的CASP14高难度测试集上,该模型超越了同类流匹配模型ESMFold
这项研究成果表明,通过优化的训练策略和适当的模型规模,可以实现接近顶级蛋白质预测系统的性能表现。该系统在预测精度和计算效率之间取得了良好平衡,为后续研究提供了重要参考。
- 值得注意的是*,在计算效率方面,搭载M2 Max芯片的MacBook Pro展现出了卓越性能。经实测,该设备处理512残基序列的推理时间仅需2-3分钟,相较传统模型动辄数小时的运算耗时,实现了数量级的提升。
这一性能突破主要得益于芯片架构优化与算法并行计算能力的提升,显著缩短了生物信息学领域的计算等待时间。
研究团队
研究报告揭示机器学习专家Yuyang Wang的学术与职业发展路径
学术背景
- Yuyang Wang本科毕业于中国顶尖学府同济大学,随后赴美国知名研究型大学卡内基梅隆大学攻读深造。在该校就读期间,他先后获得机械工程硕士、机器学习硕士以及机械工程博士学位*。这一长期系统的学术训练为其后续科研工作奠定了坚实的理论基础和技术储备。
职业历程
- 曾在Momenta公司实习,期间从事强化学习相关研发工作
- 加入苹果公司后,最初担任AI/ML Resident职位,专注于扩散模型的前沿研究
- 凭借优异表现获晋升为苹果公司机器学习研究员,持续深耕该领域
专家指出,Yuyang Wang兼具机械工程与机器学习的双重学术背景,加之在产业界的实战经验,使其在人工智能应用研究领域具有独特的竞争优势。
华人机器学习专家Jiarui Lu的职业发展路径
Jiarui Lu作为业界知名的机器学习工程师,其学术与职业发展路径展现了卓越的专业成就。
教育背景
- 清华大学本科:毕业于中国顶尖学府清华大学
- 研究经历:在校期间曾在朱军教授实验室担任研究助理
- 卡内基梅隆大学深造:获得机器学习方向硕士学位
职业发展
- 苹果公司:2020年毕业后加入这一全球科技巨头
- 研究成果:主导开发了ToolSandbox基准测试系统,该系统专注于评估大模型工具调用能力,并已成为苹果公司重要的开源项目
Jiarui Lu的职业生涯体现了从顶尖学术机构到行业领先企业的成功转型,其研究成果对大模型评估领域做出了重要贡献。
Apple推出创新蛋白质结构预测模型iFold
苹果公司近期推出了一款突破性的蛋白质结构预测模型iFold,该成果已在国际学术平台arXiv上公开发表。iFold以其独特的算法架构和高效的预测能力,有望为生命科学和药物研发领域带来重要变革。
核心技术亮点
- 创新的神经网络架构:iFold采用前沿的深度学习技术,显著提升了蛋白质三维结构预测的准确率
- 计算效率优化:模型在保持预测精度的同时,大幅降低了计算资源需求
- 开源策略:研究团队同步公开了完整的代码实现
学术资源获取
研究人员和开发者可通过以下方式深入了解iFold的技术细节:
- 学术论文:已在arXiv平台发布(论文编号2509.18480)
- 代码仓库:项目已开源在GitHub的Apple机器学习专区
这项研究成果最初由科技媒体量子位进行专题报道,其团队持续关注人工智能领域的前沿进展。
[注:需进一步了解技术细节的读者,可查阅相关资料]


